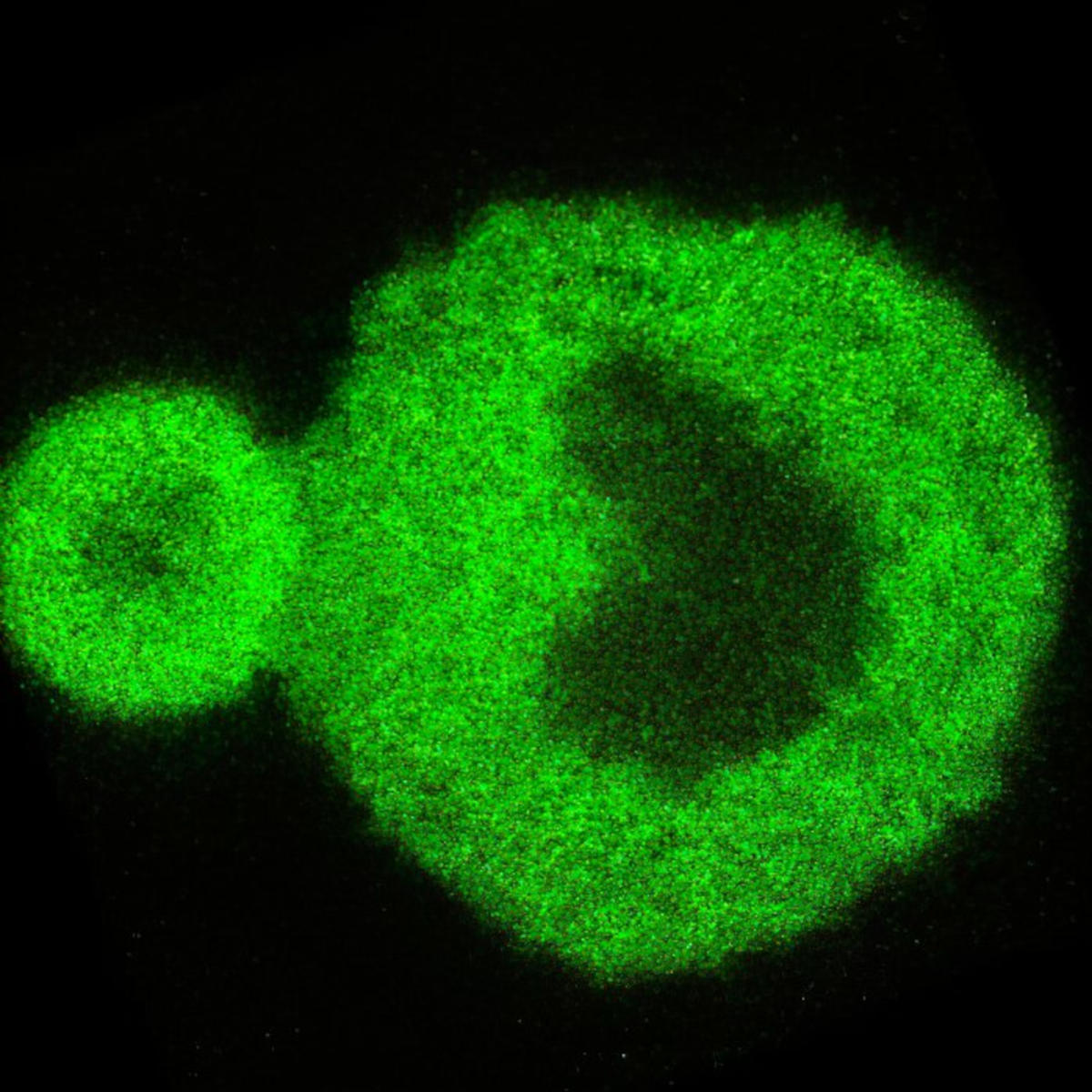
Los investigadores utilizaron técnicas ópticas avanzadas para estudiar la formación de agregados de proteínas asociados con enfermedades neurodegenerativas. Al analizar una proteína asociada con la ELA, obtuvieron información sin precedentes sobre la transición de la proteína de líquido a sólido, arrojando luz sobre afecciones como la enfermedad de Alzheimer y la ELA. Arriba hay una imagen de nanoescaneo que muestra una reacción de condensación de proteínas. Crédito: Universidad de Sydney
La observación de proteínas a nanoescala proporciona información para el tratamiento de enfermedades neurodegenerativas.
Muchas enfermedades que afectan al cerebro y al sistema nervioso están asociadas con la formación de agregados de proteínas, o condensados sólidos, en las células a partir de sus condensados líquidos, pero se sabe poco sobre este proceso.
Esta transición de líquido a sólido puede conducir a la formación de las llamadas fibrillas de amiloide. Estos pueden formar placas en las células nerviosas, provocando enfermedades neurodegenerativas como: enfermedad de alzheimer.
Ingenieros biomédicos de la Universidad de Sydney, en colaboración con científicos de la Universidad de Cambridge y la Universidad de Harvard, han desarrollado sofisticadas técnicas ópticas para monitorear de cerca el proceso mediante el cual se forman estos agregados de proteínas.
Al probar una proteína asociada con la enfermedad de esclerosis lateral amiotrófica (ELA), que afecta al astrofísico profesor Stephen Hawking, los ingenieros de Sydney siguieron de cerca la transición de su fase líquida a sólida.
Microscopía de barrido confocal 3D del condensado de proteína FUS incubado durante 24 h que muestra la estructura característica núcleo-corteza revelada por esta investigación. crédito: f Universidad de Sídney
“Este es un gran paso hacia la comprensión de cómo se desarrollan las enfermedades neurológicas desde una perspectiva fundamental”, afirmó el Dr. Yi Xin, autor principal de la investigación publicada en la revista Neurology. procedimientos de la Academia Nacional de Ciencias (PNAS) en los Estados Unidos.
“Ahora podemos observar directamente la transición de estas importantes proteínas de líquido a sólido en nanoescala “Es una millonésima de metro”, dijo el Dr. Daniel Figullo, profesor titular de la Escuela de Ingeniería Biomédica y miembro del Nano Instituto de la Universidad de Sydney.
Las proteínas forman regularmente condensados durante la separación de fases de líquido a líquido en una amplia gama de funciones biológicas críticas y saludables, como la formación de embriones humanos. Este proceso ayuda a las reacciones bioquímicas donde las concentraciones de proteínas son críticas y también promueve interacciones saludables entre proteínas.

El equipo de investigación de Vigolo y Shane. Crédito: Universidad de Sydney
“Sin embargo, este proceso también aumenta el riesgo de agregación disfuncional, mediante la cual se forman agregados nocivos de proteínas rígidas en las células humanas”, dijo el Dr. Shen, miembro de ARC DECRA en la Escuela de Ingeniería Química y Biomolecular y miembro de Sydney Nano. .
“Esto puede provocar estructuras anormales asociadas con enfermedades neurodegenerativas, porque las proteínas ya no muestran una rápida reversibilidad a la forma líquida. Por lo tanto, es necesario controlar la dinámica de los condensadores, ya que afectan directamente a los estados patológicos”, afirmó.
La primera observación óptica a nanoescala del mundo de este proceso permitió al equipo determinar que la transición de una proteína líquida a una proteína sólida comienza en la interfaz de los adsorbatos de proteínas. Esta ventana a la transición también reveló que las estructuras internas de estos agregados de proteínas son heterogéneas, como antes se pensaba que eran homogéneas.
El Dr. Vigolo dijo: “Nuestros hallazgos prometen mejorar enormemente nuestra comprensión de las enfermedades neurológicas desde una perspectiva fundamental.
“Esto significa una nueva y prometedora área de investigación para comprender mejor cómo la enfermedad de Alzheimer y la ELA progresan en el cerebro y afectan a millones de personas en todo el mundo”.
Referencia: “La transición FUS de líquido a sólido se ve reforzada por el condensado superficial” por Yi Shen, Anqi Chen, Wenyun Wang, Yinan Shen, Francesco Simone Ruggeri, Stefano Aime, Zizhao Wang, Seema Qamar, Jorge R. Espinosa, Adiran Garrizar, disponible Aquí: Peter St. George Heslop, Rosanna Colibardo Guevara, David A. Weitz, Danielle Figullo y Thomas PJ Knowles, 7 de agosto de 2023, disponible aquí. procedimientos de la Academia Nacional de Ciencias.
doi: 10.1073/pnas.2301366120
El estudio fue financiado por la Fundación Francis y Augustus Newman, Wellcome Trust, el Consejo Europeo de Investigación, la Asociación Estadounidense de Alzheimer, ALS Canada-Brain Canada, los Institutos Canadienses de Investigación en Salud y el Instituto Nacional sobre el Envejecimiento.

“Futuro ídolo adolescente. Explorador amigable. Alborotador. Especialista en música. Practicante ávido de las redes sociales. Solucionador de problemas”.





More Stories
Compensar el sueño los fines de semana puede reducir el riesgo de enfermedad cardíaca en una quinta parte: estudio | Cardiopatía
¿Cómo se hicieron los agujeros negros tan grandes y rápidos? La respuesta está en la oscuridad.
Una estudiante de la Universidad de Carolina del Norte se convertirá en la mujer más joven en cruzar las fronteras del espacio a bordo de Blue Origin